血小板在肝细胞癌发生发展中的作用
肝细胞癌(HCC)是指起源于肝细胞的恶性肿瘤,已经成为全世界癌症相关死亡的第三大原因[1]。近年研究[2]表明,血小板在肝再生及肝纤维化、HCC的进展中发挥着重要的作用。血小板不仅参与止血,活化的血小板还能产生细胞因子以及通过复杂的信号通路与肝细胞及肿瘤微环境相互作用,促进肿瘤的发生与进展。研究发现,抗血小板治疗能减弱肝脏的炎症并改善HCC患者的预后[3],阿司匹林等抗血小板药物也具有抗癌活性,能通过抑制血小板相关通路延缓肿瘤的进展[4],此外,针对血小板与肿瘤微环境相关通路的靶向治疗对HCC的防治具有潜在的临床意义。
1血小板与HCC的关系
近年越来越多的研究[5]证据表明,血小板在HCC发生发展中扮演着重要的角色。HCC主要发生在慢性炎症和肝脏慢性损伤的情况下,血小板及其衍生物与肝脏微环境相互作用促进HCC的发生发展。当肝脏发生器官损伤或炎症等病理改变时,血小板聚集在肝脏中并被激活,释放大量细胞因子并与肝脏微环境相互作用,通过增强炎症反应、免疫抑制、免疫逃逸、诱导新生血管的形成等方式刺激癌细胞的增殖及转移。另一方面,癌细胞也能募集和激活血小板,帮助其增殖和转移[5](图 1)。
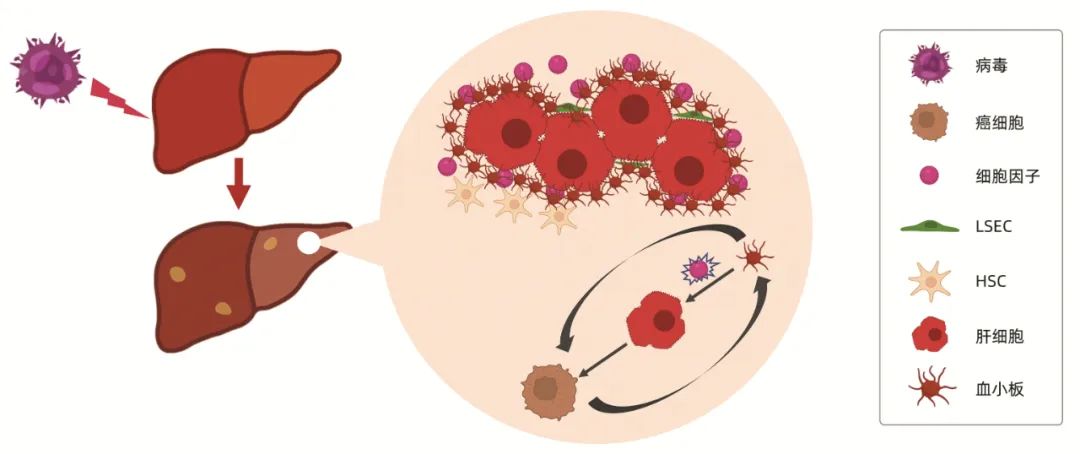
图 1 血小板与HCC的关系
注:LSEC,肝窦内皮细胞;HSC,肝星状细胞。
2血小板促进HCC发生发展的可能机制
2.1 血小板作用于肿瘤微环境中的多种细胞成分促进肿瘤进展
肿瘤微环境由周围血管、细胞外基质、成纤维细胞、淋巴细胞、信号分子、免疫细胞和炎症细胞等组成,它是肿瘤生存的细胞环境。肿瘤微环境中的各种细胞通过释放细胞因子、促进肿瘤血管生成、诱导免疫耐受等方式加速肿瘤微环境的形成。同时,肿瘤微环境能够影响癌细胞的生长和分化[6]。血小板及其分泌的细胞因子与肿瘤微环境中的各种成分相互作用,促进肿瘤的进展(图2)。
图2 肿瘤微环境
注:TAF,肿瘤相关成纤维细胞。
血小板与LSEC相互作用促进HCC的进展。在生理条件下,LSEC调节肝脏血管张力并维持HSC静止,从而抑制肝内血管收缩和纤维化。血小板能够分泌多种生长因子如肝细胞生长因子(HGF)及IL-6,刺激肝细胞及LSEC再生。在肝损伤的早期阶段,血小板被招募至肝脏并且黏附于LSEC上并被活化,活化的血小板导致LSEC窗孔消失并发生“毛细血管化”, 失去其生理作用,促进血管生成和血管收缩,导致HCC的进展。在免疫调节方面,LSEC通过上调胞间黏附分子1(ICAM-1)和血管黏附蛋白1(VAP-1)的表达导致白细胞跨膜迁移,并诱导T淋巴细胞分化,降低其毒性,从而增加肝细胞的炎症反应。现有的临床证据和基础研究[7-9]均证实血小板及其衍生物可促进肝再生,而肝再生的异常可导致肝纤维化和HCC的发生。血小板与肿瘤微环境相互作用,成为HCC进展的积极参与者。然而,肝纤维化及HCC患者血小板功能的改变目前仍是一个争议点,需要更多的研究来解决此争议。
血小板和HSC及肝脏Kupffer细胞相互作用促进HCC的发生。肿瘤相关巨噬细胞能够分泌IL-6并通过STAT3信号通路促进肿瘤细胞增殖[10]。近年研究[11]发现,血小板能够产生直接影响HSC活化的细胞因子和趋化因子,包括血小板源性生长因子(PDGF)、TGFβ、TNF、IL-1β、单核细胞趋化因子1等,并通过NF-κB等通路影响HSC的活化。当各种因素造成肝损伤时,HSC在这些细胞因子的刺激下被激活成可收缩的肌成纤维细胞,产生大量的细胞外基质,促进Ⅰ、Ⅲ型胶原的转录[12],导致纤维形成、收缩、基质降解和促炎信号传导,最终使得细胞外基质重构和纤维化,进而导致HCC的进展。目前关于HSC活化的调节因子信号分子及相关调节通路的研究层出不穷,及时更新有关HSC活化的新靶点、新通路的信息对于临床药物的研发有重要意义。
血小板产生的外泌体是肿瘤微环境各成分间相互作用的关键载体。近年研究[13]表明,外泌体在肿瘤微环境中作为各类生长因子、细胞因子、酶类及遗传物质的载体,广泛参与了肿瘤细胞和肿瘤微环境间的双向交流。研究[14]发现,血小板可释放直径40~100 nm的外泌体,其内容物包括各类胞质、胞膜蛋白和小分子RNA等。血小板产生的外泌体通过刺激巨噬细胞增加IL-6、IL-1β、IL-10、TNFα等细胞因子的分泌,激活STAT3通路,增加程序性死亡配体(PD-L1) 蛋白表达,从而抑制免疫细胞的激活,导致免疫逃避进而促进HCC的进展[15]。外泌体还能诱导血管内皮生长因子(VEGF)的产生从而增加血管生成,以利于肿瘤细胞的迁移[16]。另有研究[17]发现,外泌体可通过TGFβ通路激活HSC,促进肝炎和肝纤维化的发生。此外,外泌体能够将HSC转化成TAF,促进肿瘤的进展[18]。由此可知,血小板主要通过外泌体的形式分泌多种细胞因子,与肿瘤微环境中的各种成分相互作用,诱导癌细胞免疫抑制,免疫逃避,并促进肿瘤新生血管的形成,最终导致HCC的进展。外泌体通过调节肿瘤微环境的耐受度来调节免疫反应和肿瘤抑制,说明其在治疗HCC中具有作为药物靶点和载体的潜在可能性,有望在未来为HCC的诊断及治疗提供新的依据。
2.2 血小板通过促进肿瘤微环境中新生血管的生成促进HCC进展(图3)
图3 血小板与肿瘤微环境相互作用促进HCC进展
缺氧诱导的新生血管的形成是导致HCC进展及转移的重要因素之一[19]。Chen等[20]研究发现,肿瘤的血管异常是导致肿瘤灌注受限、肿瘤微环境缺氧、免疫抑制的重要原因,用抗肿瘤药物如厄洛替尼使肿瘤血管正常化,能够增加免疫治疗的疗效。在肿瘤微环境中,血小板通过直接黏附于血管受损处或以外泌体的形式分泌5-羟色胺(5-HT)、血小板第四因子(PF-4)、TGFβ等颗粒内容物维持肿瘤血管内皮的完整,阻止肿瘤内出血,防止肿瘤组织的缺血坏死[21]。研究[22]显示,在HCC患者中,VEGF和HGF的水平显著升高,肿瘤组织能够分泌VEGF激活邻近血管内皮细胞上表达的血管内皮生长因子受体-2,并通过信号分子δ样蛋白配体-4和血管生成素2等细胞因子的参与启动肿瘤血管生成[23]。
炎症反应及中性粒细胞的过度活化可刺激血管的生成,并通过分泌HGF-2刺激肿瘤的生长[24]。当炎症导致内皮下胶原暴露时,血小板通过一系列信号通路被激活并释放一系列细胞因子,其中包括P-选择素,P-选择素被激活后暴露在血小板表面,与内皮细胞表达的P-选择素糖蛋白配体-1相结合,从而使血小板与内皮细胞相结合,与此同时分泌细胞因子如PF-4和血小板碱性蛋白,使得中性粒细胞趋化并黏附在内皮细胞表面以及单核细胞上,刺激血管的生成[25]。
血小板通过释放PDGF促进HSC的活化,刺激新生血管的生成。研究[26]显示,血小板产生的PDGFβ是HSC活化的主要驱动因素,并且是体内合成细胞外基质和肝硬化的关键启动因子。在低氧条件下,PDGF可刺激HSC在肿瘤微环境中聚集和增殖,从而造成HSC VEGF-A表达增强,使得HCC组织中新生血管的形成,促进肿瘤的增殖和转移[27]。综合目前研究结果,可以得知血小板可分泌多种细胞因子通过复杂的信号通路促进新生血管的生成,血小板及其衍生物还能与中性粒细胞及HSC相互作用,共同促进肿瘤新生血管的生成促进肿瘤进展。
2.3 血小板活化后通过“免疫逃逸”介导HCC进展及转移
有相关研究[28]结果显示,血小板分泌的TGFβ作为一种免疫抑制因子使得肿瘤微环境维持充分的免疫抑制状态,如果用化疗药物如NO或紫杉醇特异性阻断血小板与肿瘤细胞的相互作用,能够抑制肿瘤上皮-间质转化的过程,防止血小板黏附于肿瘤组织周围,并抑制血小板和肿瘤组织分泌TGFβ,从而逆转肿瘤微环境中免疫抑制状态。由此可知,以保护癌细胞免受免疫系统攻击的方式改变了微环境,是导致免疫治疗药物失败的主要原因。因此,有效抑制TGFβ的成熟或功能将为癌症治疗开辟新的途径。
血小板来源的主要组织相容性复合物I存在自身抗原,不会诱导免疫细胞对转移肿瘤细胞的反应,而血小板来源的人类白细胞抗原A变异株-2(HLA-A*02)能够从血小板转移到肿瘤细胞表面,通过表达主要组织相容性复合物Ⅰ类分子介导肿瘤细胞的“免疫逃逸”,从而抑制自然杀伤细胞驱动的抗肿瘤免疫[29]。其次,血小板细胞膜上表达多种蛋白质,如P-选择素、血小板糖蛋白等,这些蛋白质能使血小板与癌细胞凝聚在一起并形成转移位点,使得癌细胞黏附于血管壁。被癌细胞激活的血小板释放ATP,并通过Gq/GⅡ信号通路提高细胞内的钙离子水平,再激活蛋白激酶C提高血管内皮屏障的通透性使得癌细胞透过血管壁在血管外迁移[30]。综上可知,血小板表面的糖蛋白及其分泌的细胞因子能通过抑制免疫、增强趋化、提高血管内皮通透性等途径促进癌细胞的迁移,促进HCC的进展。
3抗血小板治疗在HCC靶向治疗方面的可能性
抑制血小板相关受体及通路可抑制肿瘤进展[3]。在肿瘤早期阶段,血小板来源的RNA可以检测包括HCC在内的多种癌细胞,因此血小板可以作为潜在的生物标志物来预测癌症[31]。德国科学家研究[32]发现,血小板膜糖蛋白Ⅳ是肿瘤血管完整性的关键调节剂,抑制该靶点可增大肿瘤血管的通透性使其发生大出血,并且还可以提升肿瘤血管内的化疗药物浓度达到治疗效果。因此基于对血小板功能的开发可作为抗肿瘤策略的基础。哈佛大学某团队研究[33]显示,去除外部脂质膜和内部成分的血小板能够完全阻止癌细胞侵入的过程,这表明血小板可以阻止新肿瘤的形成。此外,血小板糖蛋白Ⅰbα(GpⅠbα)抗体也是HCC治疗的潜在靶点。GpⅠbα是HCC发生的一种介质,主要通过与Kupffer细胞的相互作用参与HCC的发生。小鼠实验[34]发现GpⅠbα抗体治疗HCC自发性出血率较低,抑制血小板GpⅠbα受体治疗HCC的潜力值得关注。综上可知,这些发现在分子和临床水平均验证了抗血小板治疗抗肿瘤的可行性,开启了肿瘤治疗的新时代,同时抗血小板药物也成为了治疗肿瘤的重要手段,但其临床有效性和安全性仍值得进一步探索和研究。在血小板作为标志物预测癌症方面,由于血小板活化会影响分析结果,因此建立稳定的纯化血小板方法有助于使得血小板成为可信的癌症生物标志物。
肿瘤微环境已成为抗癌治疗的重要靶点[35]。TAF作为主要靶点之一用于HCC的治疗,可通过干扰促肿瘤信号抑制肿瘤的进展[36]。成纤维细胞活化蛋白作为TAF的特异性标志物,其介导的信号成纤维细胞活化蛋白-CCl2有可能成为肿瘤治疗的靶点[37]。此外,在肿瘤生长过程中产生的细胞外基质分子的某些水解片段,也具有强大的信号特性,可作为治疗靶点调节肿瘤的生长和转移[38]。与此同时,使用抗VEGF分子靶向药物改善肿瘤血管状态和抗PD-1/PD-L1免疫抑制剂在理论上具有协同抗癌作用[39]。目前针对肿瘤微环境的靶向治疗已取得了重大进展,但尚无改善临床结局的治疗方案,因此更好的结合基质耗竭和免疫调节机制研究多种靶向治疗方法来延长癌症患者生存期是非常有必要的。
LSEC衍生的“血管分泌因子”及HSC是HCC治疗的潜在靶点。Winkler等[40]研究发现,LSEC GATA4的缺失会通过下调Wnt通路导致肝再生受损,并通过复杂的信号通路激活HSC,导致LSEC的“血管化”。因此,可通过阻止血管分泌信号如PDGFB来控制肝纤维化和再生,以GATA4/MYC/PDGFB/PDGFRβ轴为靶点的治疗为肝纤维化和HCC的预防提供了一种可能的策略。此外,LSEC毛细血管化是触发HSC激活、肝纤维化和炎症的早期病理事件[41]。骨形态发生蛋白(BMP)9是一种由HSC产生的旁分泌因子[42],BMP9基因敲除小鼠中LSEC特异性转录因子GATA4表达下降,同时发生炎症和纤维化,这表明BMP9可控制肝纤维化和HCC的进展[43]。BMP9基因缺失导致肝纤维化的相关模型可以测试创新抗纤维化及HCC的药物[44]。然而,在人类肝硬化、HCC的肝脏中,BMP9表达降低[45],由此可知,BMP9在人类肝纤维化、HCC中的作用仍需要进一步研究。目前,大量的基础实验结果及分子理论均表明抗血小板也有抗癌的效果,在临床上早期使用抗血小板药物治疗有可能阻止HCC的进展,然而现实中大多数由肝硬化导致的HCC患者出血风险较高,在保证抗血小板药物抗癌作用的前提下如何避免出血风险,还需要更深入的研究来进一步探讨。
4小结
作为凝血反应的激活物,血小板不仅参与止血,还能分泌多种细胞因子通过复杂的信号通路与肿瘤微环境相互作用,通过免疫逃逸、免疫抑制、新生血管的形成促进HCC的进展。在治疗方面,靶向治疗目前已经成为HCC重要的治疗手段。在分子水平及小鼠实验中发现,与血小板相关的多个信号分子都可以作为HCC治疗的靶点。在临床上,血小板在HCC治疗中的作用需要进一步研究及探讨。此外,作为一种廉价、容易测得的指标,通过监测血小板计数预测肝癌患者的预后也具有很重要的临床意义。因此,在未来靶向治疗中,血小板的作用值得进一步研究和探讨。

扫描二维码或点击以下链接
查看原文或免费下载PDF
http://www.lcgdbzz.org/cn/article/doi/10.3969/j.issn.1001-5256.2022.06.043
于潇, 武国兵, 张爱斌, 等. 血小板在肝细胞癌发生发展中的作用[J]. 临床肝胆病杂志, 2022, 38(6): 1426-1430.
本文编辑:王亚南
公众号编辑:邢翔宇






